Folates, Vitamine B9 ?
Folates, Vitamine B9, qu’est ce que c’est ?
L’acide folique ou Vitamine B9 ou Acide Ptéroyl Glutamique a été identifiée en 1930 à l’origine comme substance capable de prévenir de l’anémie mégaloblastique pendant la grossesse. Ce n’est qu’en 1941 qu’elle va prendre son nom actuel : l’acide folique.
Elle tient son nom de « feuilles » où elle est présente en abondance. Elle existe également à l’état de polyglutamates dans l’alimentation et doit être réduite en monoglutamates afin d’être biologiquement active.
Elle est extrêmement sensible à la chaleur (thermolabile), l’oxydation, et elle est protégée par l’acide ascorbique. Ces polyglutamates sont réduits dans la lumière digestive en acide folique avant d’être absorbés par l’entérocyte où elle est réduite à nouveau et méthylée puis excrétée dans le sang avant d’être distribué aux différents tissus. Elle doit ensuite être déméthylée pour intégrer le cycle folique de la cellule.
L’acide folique participe au don d’unités monocarbonées nécessaires à la synthèse des purines, méthionine, et acide thymidylique constitutifs de l’ADN. C’est pourquoi un déficit en folate se traduit par des troubles de la division cellulaire. Les lignées à renouvellement rapide sont particulièrement touchées. L’hematopoïèse est concernée précocement et se traduit par une anémie mégaloblastique.
Les tissus embryonnaires et fœtaux ont une multiplication rapide et sont donc particulièrement vulnérables. Les complications se traduisent par des avortements spontanés, des retards de croissance intra-utérins, et des malformations telles que les ATN. Il existe donc une augmentation des besoins en folates pendant la grossesse afin d’assurer la bonne croissance du fœtus et de lui constituer des réserves suffisantes en folates pour la vie extra-utérine.
Origines alimentaires
Quelques données sous forme de tableau :
|
Teneur en folates |
Aliments |
|
Très riche (>200) |
Levure, foie |
|
Riche (100 à 200) |
Epinard, laitue, haricots, amandes, noix, châtaignes, cacahuètes |
|
Moyenne (50 à 100) |
Autres légumes verts, pois chiches, œufs, fromages fermentés, beurre de cacahuètes |
|
Faibles (25 à 50) |
Autres légumes, agrumes, bananes, baies, pain complet, pain blanc |
|
Pauvre (< 25) |
Viandes, poissons, autres fruits, autres laitages |
Aspects biochimiques et génétiques du métabolisme des Folates
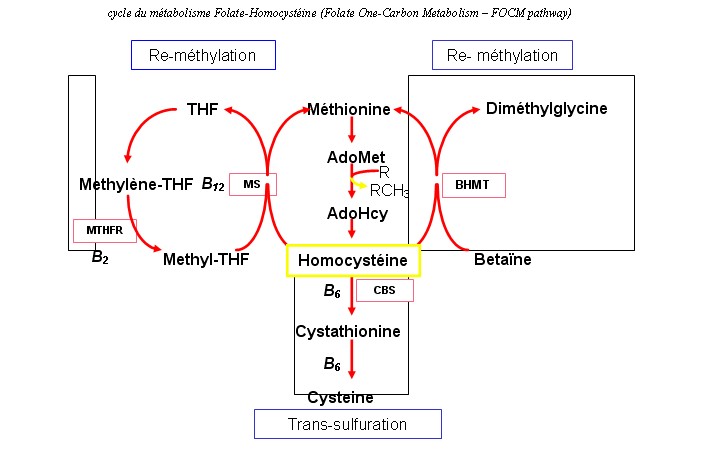
Cette recherche a débuté en 1994 par la description du premier polymorphisme du gène MTHFR. Depuis lors, le cycle du métabolisme Folate-Homocystéine (Folate One-Carbon Metabolism – FOCM pathway) a été décrypté et de nombreux polymorphismes (SNP ou mutations plus complexes) décrits. Les études n’ont par contre jamais apporté la preuve de l’association de mutations délétères dans ces gènes et de la survenue de MTN.
Les progrès réalisés ces dix dernières années dans le domaine génétique et la physio-pathologie permettent de mieux comprendre les troubles du métabolisme des folates et de l’homocystéine. Le rôle des folates est essentiel dans la division cellulaire : Le folate est un co-facteur majeur du métabolisme de l’homocystéine, acide aminé inversement corrélé au taux de folate sérique. Une augmentation de l’homocystéine dans le plasma de mères d’enfants atteints de MTN a été décrite pendant (ADAMS , 1995 – CANDITO, 2008) et après la fin de la grossesse. La carence en vitamine B12 étant aussi évoquée dans l’étiologie des MTN (CANDITO, 2008) .
cycle du métabolisme Folate-Homocystéine (Folate One-Carbon Metabolism – FOCM pathway)
Il était admis que le traitement par l’acide folique corrigeait une carence. Les dosages de folates et de vitamine B 12 chez les mères (DAWSON EB 1998, CANDITO 2008) d’enfants atteints de MTN ont donné des résultats inférieurs à celles des mères d’enfants normaux, et l’homocystéinémie en moyenne plus élevée (CANDITO M, 2001 et 2008). L’effet protecteur de l’acide folique pourrait être la correction de besoins accrus par prédisposition génétique (mutation sur les gènes d’enzymes ayant pour co-facteur le folate telle la reméthylation de l’homocystéine en méthionine).
La connaissance des gènes du métabolisme des folates ouvre de nouvelles voies : plutôt que des mutations délétères, ce sont des polymorphismes influant le métabolisme qui ont été découverts. (Les modifications des cinétiques sont de l’ordre de 10 à 50%). Ainsi la mutation C677T sur le gène de la MTHFR est un polymorphisme génétique reconnu associé à une hyperhomocystéinémie modérée et à une augmentation du risque de MTN. Reste le rôle possible du multi-génisme. Deux mutations ou polymorphismes sur deux gènes différents peuvent être des co-facteurs pour la survenue de troubles de ce métabolisme (CANDITO 2008). Mais les études croisées sur ces gènes dans des populations de mères d’enfants MTN ne donnent pas encore la clé du problème.
Quelques un des gènes de la voie Folate-homocystéine (FOCM patway) et fréquence européenne de quelques allèles mutés.
|
gène |
polymorphismes : |
Fréquence des allèles mutés |
|
MTHFR (5,10-Methylene tetrahydrofolate reductase) |
677T 1298C |
0.36 0.35 |
|
MTHFD1 (Methylene THF deshydrogenase/-/-) |
1958G>A |
|
|
SHMT1 (Serine hydroxymethyltransferase) |
1420C>T |
0.36 |
|
MTRR (Methionine Synthase réductase) |
66A>G |
0.40-0.51 |
|
MR (ou MTR) (Methionine Synthase) |
2756A>G |
0.17 |
|
CBS (Cystathionine b-synthase) |
844ins68 |
0.33 |
|
RFC1 (Reduced Folate Carrier) |
G80A |
0.52 |
|
TCN2 (transcobalamine) |
776C>G |
0.43 |
|
BHMT (Betaine-Homocysteine S methyltransferase) |
742G>A |
0.30 |
La liste s’allonge régulièrement et l’on différencie les gènes du cycle Hcy-Folates et ceux qui gèrent le parcours de l’absorption et du transport. Il reste très difficile d’attribuer les responsabilités à ces modifications « naturelles » et les études pharmacodynamiques sont encore utiles. Enfin la méthylation de l’ADN est aussi en cause et responsable potentielle de la modification de l’action de gènes du développement.
En pratique, les dosages sanguins doivent être fait pour ne pas méconnaître des carences ou des anomalies. Les études moléculaires ne peuvent encore être utilisée pour une cartographie individuelle de risque. Seul le phénotype MTHFR C/C, C/T ou T/T est actuellement associé aux MTN de façon quasi certaine. Les autres gènes et leurs polymorphismes restent un modèle d’étude dont les associations méritent une meilleure compréhension.
Recevoir les mises à jour du blog par email